RANGKUMAN
GAS IDEAL
dari ninis_hida-fst12.web.unair.ac.id
Teori molekul tentang gas ideal diasumsikan sebagai berikut :
- Gas terdiri atas partikel-partikel dalam jumlah yang banyak sekali.
- Partikel-partikel itu dianggap sebagai bola kecil yang keras dan lenting sempurna.
- Antara partikel yang satu dengan partikel yang lain tidak ada gaya kohesi.
- Jarak antara partikel satu dengan partikel lainnya jauh lebih besar dibanding ukuran partikel itu sendiri.
- Partikel-partikel itu senantiasa bergerak ke sembarang arah dan tersebar merata dalam ruangan.
- Suatu gas terdiri atas molekul-molekul yang identik sehingga tidak dapat dibedakan dengan molekul lainnya.
- Hukum-hukum Newton tentang gerak berlaku pada molekul gas ideal.
Hukum-hukum Tentang Gas Ideal
- Hukum Boyle
( Robert Boyle ) dari apprendre-math.info
Hukum Boyle menyatakan bahwa pada suhu tetap, perkalian antara tekanan P dan volume V suatu gas di ruang tertutup selalu konstan.
P.V=C
P.V=C
C suatu nilai yang konstan atau dapat juga ditulis :
P1V1=P2V2
P1V1=P2V2
- Hukum Gay Lussac
( Louise Gay Lussac ) dari brunelleschi .imss.fi.it
Hukum Gay Lussac menyatakan bahwa perbandingan volume V suatu gas dengan suhu mutlak selalu konstan. Hukum Gay Lussac disebut juga hukum Charles.
Dengan :
P = tekanan gas ( N/m3 )
V = volume gas ( m3 )
T = suhu (K) = ( 273o+to)C
N = banyaknya partikel
k = konstanta Boltzman = 1,3807 x 10-23 J/K
R = tetapan gas umum = 8,31 J/mol.K = 0,0821 liter.atm/mol.K
n = jumlah mol
jumlah partikel 1 mol gas = 6,02 x 1023 partikel.
- Hukum Boyle-Gay Lussac
Eturan-aturan yang perlu diperhatikan un tuk menggunakan persamaan ini adalah sebagai berikut :
- Massa gas harus tetap.
- Suhu T1 dan T2 harus dinyatakan dengan Kelvin (K).
- Satuan P dan V pada kedua ruas harus sama.
Teori Kinetik Gas Ideal
Dengan :
P = tekanan gas (Pa atau N/m2)
mo = massa sebuah partikel gas (kg)
V2 = rata-rata kuadrat kecepatan (m2/s2)
N = jumalah partikel gas
V = volume gas (m2)
- Hubungan temperatur Terhadap Energi Dalam
Dalam setiap energi terdiri atas dua bagian , yaitu :
- Energi akibat gerak partikel-partikel yang teratur di dalam sistem.
- Energi akibat gerak partikel-partikel yang tidak teratur di dalam sistem ( disebut juga energi termal)
Energi termal akibat gerak partikel-partikel yang tidak teratur digunakan untuk perhitungan dalam teori kinetik gas.
Energi dalam bentuk termal ( simbolnya U) dari suatu sistem yang mengandung N buah partikel adalah :
- Untuk gas-gas monoatomik seperti He, Ne, dan Ar memiliki γ=3Jadi,

- Untuk gas-gas diatomik seperti H2, O2, dan N2 derajat kebebasannya tergantung suhu.
Pada suhu rendah (sekitar 250 K) memiliki γ=3
Jadi, 

Pada suhu sedang (sekitar 500 K) memiliki γ=5
Jadi, 

Pada suhu tinggi (sekitar 1000 K) memiliki γ=7
HUBUNGAN GAS IDEAL FISIKA DENGAN ILMU KIMIA
Gas merupakan satu dari tiga wujud zat, dan wujud ini merupakan bagian tak terpisahkan dari studi kimia.
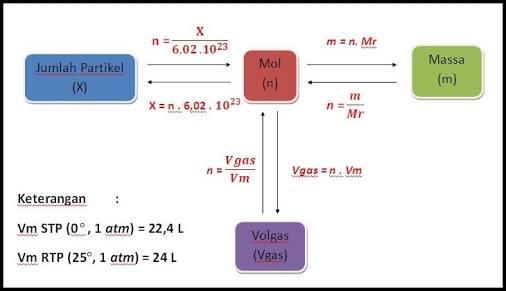
Pengukuran kuantitas gas tergantung suhu dan tekanan gas. Jika gas diukur pada keadaan standar, maka volumenya disebut volume molar. Volume molar adalah volume 1 mol gas yang diukur pada keadaan standar. Keadaan standar yaitu keadaan pada suhu 0⁰C atau 273 K dan tekanan 1 atm atau 76 cmHg atau 760 mmHg, keadaan ini disingkat STP ( Standard Temperatur and Pressure ).
Besarnya volume molar gas dapat ditentukan dengan persamaan gas ideal : P.V = n.R.T
sumber : likiwidy.wordpress.com
P = tekana 1 atm
P = tekana 1 atm
T = suhu dalam kelvin = 273 K
R = tetapan gas = 0,082 liter atm/mol.K
Maka:
P.V = n.R.T
V = 1. 0,082 .273
V = 22, 389
V = 22,4 liter
Jadi, volume standar = VSTP = 22,4 liter/mol
Dapat dirumuskan V = n. Vm
n = jumlah mol
Vm = VSTP = volume molar.
(https://istiistiqomah085.wordpress.com/2014/01/16/konsep-mol-dan-perhitungan-kimia/)
Salah satu hubungan yang lain adalah persamaan gas ideal dapat digunakan di dalam ilmu kimia untuk menentukan berat molekul senyawa volatil berdasarkan pengukuran massa jenis gas.
Gas mempunyai sifat bahwa molekul-molekulnya sangat berjauhan satu sama lain sehingga hampir tidak ada gaya tarik menarik atau tolak-menolak diantara molekul-molekulnya sehingga gas akan mengembang dan mengisi seluruh ruang yang ditempatinya, bagaimana pun besar dan bentuknya. Untuk memudahkan mempelajari sifat-sifat gas ini perlu diketahui beberapa sifat gas ideal berikut ini:
- Tidak ada gaya tarik-menari di antara molekul-molekulnya.
- Volume dari molekul-molekul gas sendiri di abaikan.
- Tidak ada perubahan energi dalam ( Internal energy = E ) pada pengembangan.
Sifat-sifat ini didekati oleh gas inert (He, Ne, Ar, dll) dan uap Hg dalam keadaan yang sangat encer. Gas yang umunya terdapat di alam (gas sejati) misalnya: N2, O2, CO2, NH3, dan lain-lain sifatnya agak menyimpang dari gas ideal.
Densiti dari gas dipergunakan untuk menghitung berat molekul suatu gas, ialah dengan cara membendungkan suatu volume gas yang akan dihitung berat molekulnya dengan berat gas yang telah diketahui berat molekulnya (sebagai standar) pada temperatur atu suhu dan tekanan yang sama. Densiti gas didefinisikan sebagai berat gas dalam gram per liter. Untuk menentukan berat molekul ini maka ditimbang sejumlah gas tertentu kemudian diukur PV dan T-nya. Menurut hukum gas ideal:
Bila gas ideal sifat-sifatnya dapat dinyatakan dengan persamaan yang sederhana yaitu P.V = n.R.T , maka sifat=sifat gas sejati hanya dapat dinyatakan dengan persamaan, yang lebih kompleks lebih-lebih pada tekanan yang tinggi dan temperatur yang rendah. Bila diinginkan penentuan berat mlekul secara teliti mak hukum-hukum gas ideal dipergunakan pada tekanan yang rendah. Tetapi akn terjadi kesukaran ialah bila tekanan rendah maka suatu berat tertentu dari suatu gas akan mempunyai volume yang sangat besar. Untuk suatu berat tertentu jika tekanan berkurang volume bertambah dan berat per liter berkurang. Densiti yang didefinisikan sebagai W/V berkurang tetapi perbandingan densiti dan tekanan d/p atau W/ pV akan tetap, sebab berat total W tetap dan bila gas dianggap ga ideal pV juga tetap sesuai dengan persamaan berikut:
Bila
gas ideal sifat-sifatnya dapat dinyatakan dengan persamaan yang
sederhana yaitu P.V = n.R.T , maka sifat=sifat gas sejati hanya dapat
dinyatakan dengan persamaan, yang lebih kompleks lebih-lebih pada
tekanan yang tinggi dan temperatur yang rendah. Bila diinginkan
penentuan berat mlekul secara teliti mak hukum-hukum gas ideal
dipergunakan pada tekanan yang rendah. Tetapi akn terjadi kesukaran
ialah bila tekanan rendah maka suatu berat tertentu dari suatu gas akan
mempunyai volume yang sangat besar. Untuk suatu berat tertentu jika
tekanan berkurang volume bertambah dan berat per liter berkurang.
Densiti yang didefinisikan sebagai W/V berkurang tetapi perbandingan
densiti dan tekanan d/p atau W/ pV akan tetap, sebab berat total W tetap
dan bila gas dianggap ga ideal pV juga tetap sesuai dengan persamaan
berikut:

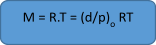

Suatu aliran dari udara kering yang bersih dilewatkan cairan yang diukur tekanan uapnya. Ketelitian dari pengukuran ini tergantung pada kejenuhan udara tersebut. Untuk menjamin kejenuhan ini maka udara dilewatkan cairan tersebut secara seri. Bila V adalah volume dari w gram cairan tersebut dalam keadaan uap, M berat mol cairan dan tekanan uap dari cairan tersebut pada temperatur T maka tekanan uap dapat dihitung dengan hukum gas ideal :
Hukum gabungan gas untuk suatu sampel gas menyatakan bahwa perbandingan PV/T adalah konstan.
Sebetulnya untuk gas-gas real (nyata) seperti metana CH3 dan oksigen dilakukan pengukuran secara cermat, ternyata hal ini tidak benar betul. Gas hipotesis yang dianggap akan mengikiti hukum gabungan gas pada berbagai suhu dan tekanan disebut gas ideal. Gas nyata akan menyimpang dari sifat gas ideal.. pada tekanan yang relatif rendah termasuk pada tekanan atmosfir serta suhu yang tinggi, semua gas akan menempati keadaan idealsehingga hukum gas gabungan dapat dipakaiuntuk segala macam gas yang digunakan (Brady, 1999).
Persamaan gas ideal bersama-sama dengan massa jenis gas dapat digunakan untuk menentukan berat molekul senyawa volatil. Dalam hal ini menyarankan konsep gas ideal, yakni gas yang akan mempunyai sifat sedarhana yang sama dibawah kondisi yang sama (Halliday, 1978).
Persamaan yang menghubungkan langsung massa molekul gas dengan rapatannya dapat diturunkan dari hukum gas ideal. Jika jumlah mol suatu gas dapat diketahui dengan membagi massanya dalam gram dengan massa molekulnya.
( googleweblight.com )
FENOMENA TERKAIT GAS IDEAL
Lilin yang mati tanpa ditiup
Ketika sedang mati lampu dan ternyata lampu sudah menyala kembali, ita pasti akan meniup lilin yang kita nyalakan ketika mati lampu tadi. Namun, bisakah nyala lilin dimatikan tanpa ditiup?
Lilin yang kita nyalakan dapat mati tanpa ditiup ataupun tertiup angin. Pada saat lilin masih menyala, ambil gelas kemudian tutup lilin dengan gelas. Jika hal ini dilakukan, nyala lilin akan padam. Masih dengan lilin yang sama, jika lilin diletakkan didalam piring kecil dan dimasukkan air kemudian lilin ditutup dengan gelas maka air akan tersedot ke dalam gelas.
Gambar :
Sumber : eksperimentsains.blogspot.com
Sumber : fisikaasyik90.blogspot.com
Mengapa hal ini bisa terjadi?
Lilin semakin lama semakin meredup karena dalam proses pembakaran dibutuhkan oksigen, namun dalam ruangan tertutup oksigen yang tersedia terbatas. Sehingga beberapa saat setelah lilin ditutup dengan gelas, api pada lilin semekin lama semakin redup sehingga akhirnya mati karena kadar oksigen yang diperlukan untuk proses pembakaran tidak mencukupi. Molekul oksigen yang hilang karena proses pembakaran , menyebabkan tekanan udara di dalam gelas lebih kecil daripada tekanan udara didi luar gelas. Hal ini sesuai dengan Hukum Boyle, bahwa volume sebanding dengan tekanan, jadi pada saat volume oksigen habis di dalam gelas maka tekanan juga akan semakin kecil. Selanjutnya tekanan mengalir dari luar ke dalam karena tekanan di luar lebih besar dari dalam gelas, sehingga menyebabkan air yang ada di sekitar gelas terhisap masuk ke dalam gelas.
CONTOH SOAL
- Gas ideal berada di dalam suatu ruang pada mulanya mempunyai volume V dan suhu T. Jika gas dipanaskan sehingga suhunya berubah menjadi 5/4 T dan tekanan berubah menjadi 2P maka volume gas berubah menjadi?
Diketahui :
Volume awal (V1) = V
Suhu awal (T1) = T
Suhu akhir (T2) = 5/4T
Tekanan awal (P1) = P
Tekanan akhir (P2) = 2P
Ditanya : Volume akhir (V2)......?
Jadi, volume gas berubah menjadi 5/8 kali volume awal.
( Gurumuda.Net)
- Volume 2 mol gas pada suhu dan tekanan standar (STP) adalah.......
Diketahui :
Jumlah mol gas (n) = 2 mol
Suhu standar (T) = 0⁰C = 0 + 273 = 273 K
Tekanan standar (P) = 1 atm = 1,013 x 105 Pascal
Konstanta gas umum (R) =8,315 Joule/mol.K
Ditanya : Volume gas (V).............?
Jawab :
Jadi, volume 2 mol gas adalah 44,8 liter.
Volume 1 mol gas adalaah 44,8 liter/2= 22,4 liter
(Gurumuda.Net)
- 4 liter gas oksigen bersuhu 27⁰C pada tekanan 2 atm ( 1 atm= 105Pa) berada dalam sebuah wadah. Jika konstanta gas umum R = 8,315 J/mol.K dan bilangan avogadro NA= 6,02 x 1023molekul, maka banyaknya molekul gas oksigen dalam wadah adalah?
Diketahui :
Volume gas (V) = 4 liter = 4 dm3 = 4 x 10-3 m3
Suhu gas (T) = 27⁰C = 27 + 273 =300 K
Tekanan gas (P) = 2 atm = 2 x 105Pa
Konstanta gas umum (R) = 8,315 J/mol.K
Bilangan avogadro NA= 6,02 x 1023
Ditanya :
Banyaknya molekul gas oksigen dalam wadah (N)?
Jawab :
Hukum Gas Ideal (dalam jumlah molekul, N)
PV=NkT
(2 x 105)( 4 x 10-3)= N(1,38 x 10-23)(300)
8 x 102 = N ( 414 x 10-23)
( Gurumuda.Net )
- Sebanyak 3 L gas argon bersuhu 27oC pada tekanan 1 atm (1 atm=105 Pa) berada di dalam tabung. Jika konstanta gas umum R = 8,314 J/mol.K dan banyaknya partikel dalam 1 mol gas 6,02 x 1023 partikel, maka banyak partikel gas argon dalam tabung tersebut adalah ................
Diketahui :
V = 3 L = 3 x 10-3 m3
T = 27oC = 300 K
P = 1 atm = 105 Pa
R = 8,314 J/mol.K
NA= 6,02 x 1023 partikel
Ditanya : N=.........?
Jawab :
(untukku-saja.blogspot.co.id)
- Sebuah bejana gas neon (Ne, massa atom =20 u) pada suhu dan tekanan standar (STP mempunyai volume 2 m3. Tentukan massa gas neon!
Diketahui :
Massa atom neon =20 gram/mol = o,02 kg/mol
Suhu standar (T)= 0°C = 237 Kelvin
Tekanan standar (P) =1 atm = 1,013 x 105 Pascal
Volume (V) = 2 m3
Ditanya :
Massa (m) gas neon?
Jawab :
Pada suhu dan tekanan standar (STP), satu mol gas apa saja termasuk gas neon mempunyai volume 22,4 L = 22,4 dm3 = 0,0448 m3.
Dengan demikian, dalam volume 2 m3 terdapat berapa mol gas neon?
Dalam volume 2 m3 terdapat 44,6 mol gas neon. Massa atom relatif gas neon adalah 20 gram/mol . ini artinya dalam 1 mol terdapat 20 gram atau 0,02 kg gas neon. Karena dalam 1 mol terdapat 0,02 gas neon maka dalam 44,6 mol terdapat (44,6 mol) (0,02 kg/mol) = 0,892 kg = 892 gram gas neon.
( Gurumuda.Net )
Daftar Pustaka
Halliday, Resnick, Walker. 2010. Physics, 7th extended edition (terjemahan). Jakarta : Erlangga
Suherman, E. 2012. Intisari dan Rumus Lengkap Fisika. Bandung: Epsilon Grup



















terimakasih sangat membantu sekali
BalasHapusMayora Indah